Efectos de observar la mirada y el rostro de individuos típicos y autistas mientras conversan
- autismoenvivo

- 5 sept 2020
- 40 Min. de lectura

POR ROSER CAÑIGUERAL, JAMIE A WARD, ANTONIA F DE C HAMILTON
Fuente: SAGE Journals
Fotografía: Jürgen Fälchie
Tablas y figuras: de los autores
Primera publicación 27 de agosto de 2020 Artículo de investigación
Información del artículo
Artículo publicado por primera vez en línea: 27 de agosto de 2020
Roser Cañigueral (1), Jamie A Ward (1, 2), Antonia F de C Hamilton (1)
1. University College London, Reino Unido.
2. Goldsmiths, Universidad de Londres, Reino Unido.
Autor para correspondencia:
Roser Cañigueral, Departamento de Psicología Clínica, Educativa y de la Salud de la UCL, 26 Bedford Way, Londres WC1H 0AP, Reino Unido. Correo electrónico: roser.canigueral.15@ucl.ac.uk
El artículo de https://creativecommons.org/licenses/by/4.0/This se distribuye bajo los términos de la Licencia de Atribución 4.0 de Creative Commons (https://creativecommons.org/licenses/by/4.0/) que permite cualquier uso, reproducción y distribución de la obra sin más permiso siempre que se atribuya la obra original según se especifica en la página de SAGE y Acceso Abierto (https://us.sagepub.com/en-us/nam/open-access-at-sage).
Resumen
La comunicación con los demás depende de intercambios coordinados de señales sociales, como la mirada y las muestras faciales. Sin embargo, esto sólo puede ocurrir cuando los compañeros son capaces de verse el uno al otro. Aunque estudios anteriores informan de que los individuos autistas tienen dificultades para planificar la mirada y hacer despliegues faciales durante la conversación, las pruebas de las tareas diarias en la vida real son escasas y variadas. A través de dos estudios, aquí investigamos cómo la mirada ocular y los despliegues faciales de los individuos autistas típicos y de alto funcionamiento son modulados por la creencia en ser vistos y el potencial para mostrar la verdadera dirección de la mirada. Los participantes fueron grabados con un sistema de seguimiento ocular y cámara de vídeo mientras completaban una tarea estructurada de preguntas y respuestas con un confederado en tres contextos sociales: vídeo pregrabado, videollamada y cara a cara. Los participantes típicos miraban menos al confederado y producían más despliegues faciales cuando eran observados y cuando hablaban. Contrariamente a nuestras hipótesis, la mirada y los patrones de movimiento facial de los participantes autistas fueron en general similares a los del grupo típico. Esto sugiere que los participantes autistas de alto rendimiento son capaces de usar la mirada y las muestras faciales como señales sociales. En estudios futuros será necesario investigar en qué medida esto refleja el comportamiento espontáneo o el uso de estrategias de compensación.
Resumen general
Cuando nos comunicamos con otras personas, intercambiamos una variedad de señales sociales a través de la mirada y las expresiones faciales. Sin embargo, los intercambios coordinados de estas señales sociales sólo pueden ocurrir cuando las personas involucradas en la interacción son capaces de verse unas a otras. Aunque estudios anteriores informan de que los individuos autistas tienen dificultades para utilizar la mirada y las expresiones faciales durante las interacciones sociales, las pruebas de tareas que implican conversaciones reales cara a cara son escasas y variadas. Aquí investigamos cómo la mirada y las expresiones faciales de los individuos autistas típicos y de alto funcionamiento se modulan por la creencia de ser vistos por otra persona, y por estar en una interacción cara a cara. Se grabó a los participantes con un sistema de seguimiento ocular y de cámara de vídeo mientras realizaban una tarea estructurada de preguntas y respuestas con un confederado en tres contextos sociales: vídeo pregrabado (no creer en ser visto, no estar cara a cara), videollamada (creer en ser visto, no estar cara a cara) y cara a cara (creer en ser visto y estar cara a cara). Los participantes típicos miraban menos al confederado y hacían más expresiones faciales cuando eran observados y cuando hablaban. Contrariamente a nuestras hipótesis, la mirada y los patrones de expresión facial de los participantes autistas fueron en general similares a los del grupo típico. Esto sugiere que los participantes autistas de alto rendimiento son capaces de usar la mirada y las expresiones faciales como señales sociales. En estudios futuros será necesario investigar en qué medida esto refleja el comportamiento espontáneo o el uso de estrategias de compensación.
Palabras clave: autismo, ser observado, doble función de la mirada, mirada ocular, expresiones faciales.
La comunicación con otras personas se basa en complejos intercambios de señales sociales, mediadas por la mirada, las expresiones faciales, el habla o los gestos. Estudios anteriores sugieren que los individuos autistas tienen dificultades para intercambiar señales sociales, particularmente a través de la mirada, pero las pruebas son contradictorias (Falck-Ytter & Von Hofsten, 2011). Una razón para ello podría ser que los diseños experimentales tradicionales en la investigación cognitiva no son verdaderamente interactivos (Redcay & Schilbach, 2019; Schilbach et al., 2013). El examen de los patrones de la mirada de las personas autistas en las interacciones en vivo, donde la mirada tiene la doble función de percibir y señalar (Argyle y Cook, 1976; Gobel y otros, 2015), podría contribuir a comprender qué mecanismos cognitivos subyacentes al comportamiento de la mirada se ven comprometidos en el autismo. El presente estudio aborda esta cuestión comprobando sistemáticamente cómo la "observación" frente a la "interacción" modula el comportamiento de la mirada de los individuos típicos y autistas.
La mirada durante las interacciones sociales
Tradicionalmente, la investigación que estudia el comportamiento de la mirada se ha centrado en cómo usamos nuestros ojos para percibir la información de las fotos y los vídeos. Las primeras investigaciones sobre la atención visual mostraron que nuestros movimientos oculares están sesgados para atender a la ubicación en la escena más destacada (Itti & Koch, 2001; Koch & Ullman, 1985; Veale et al., 2017). Sin embargo, en las escenas sociales, la atención visual está sesgada hacia los rostros y los ojos de otras personas (Bindemann et al., 2005; Birmingham et al., 2009). Este sesgo preferencial para atender a los rostros probablemente se debe a la necesidad de maximizar la información que extraemos de los demás durante las interacciones sociales (Cañigueral & Hamilton, 2019b; Yang et al., 2016). En línea con esto, Kendon (1967) propuso que durante la conversación nuestros ojos vigilen los estados de atención y las expresiones faciales de otras personas para asegurar la comprensión y aprobación mutuas (Efran, 1968; Efran & Broughton, 1966; Kleinke, 1986).
Investigaciones recientes han utilizado diseños más válidos desde el punto de vista ecológico (por ejemplo, interacciones en vivo) para comprender cómo usamos nuestros ojos para señalar información a los demás. Hasta ahora, los hallazgos sugieren que hay poca relación entre los patrones de la mirada en las tareas basadas en la computadora y los patrones de la mirada en el mundo real. Por ejemplo, los participantes sentados en una sala de espera miran menos a un confederado en vivo que también está esperando en la sala, que al mismo confederado en un videoclip (Laidlaw et al., 2011). Los participantes pueden apartar la mirada del confederado en vivo para señalar que no tienen interés en iniciar una interacción con un extraño (es decir, la norma social de desatención civil; Foulsham y otros, 2011; Goffman, 1963), o para reducir la excitación asociada al contacto visual en las interacciones en vivo (es decir, la función expresiva de la mirada descrita por Kendon) (Argyle y Dean, 1965; Kendon, 1967; Pönkänen y otros, 2011). Esto sugiere que en las interacciones vivas no comunicativas la función señalizadora de la mirada anula nuestro sesgo preferente de atender a los rostros.
Sin embargo, todavía no está claro cómo cambian los patrones de la mirada de contextos comunicativos pregrabados a contextos comunicativos en vivo, en los que se requiere que los participantes se comprometan activamente con el confederado (por ejemplo, en una conversación) (véanse Cañigueral y Hamilton, 2019a; Mansour y Kuhn, 2019, para dos estudios recientes sobre esta cuestión). Una característica importante de los intercambios comunicativos es que las pautas de la mirada están coordinadas con otras señales sociales, como el habla. En un estudio fundamental, Kendon (1967) descubrió que las transiciones entre los estados de hablante y oyente (es decir, la toma de turnos) son moduladas por la mirada, lo que sugiere que nuestros ojos tienen una función reguladora. Por ejemplo, los oradores tienden a desviar la mirada cuando empiezan a hablar y cuando dudan (para indicar que van a decir algo), pero dirigen la mirada al oyente cuando están terminando una declaración (para indicar que el oyente puede tomar el turno) (Hessels y otros, 2019; Ho y otros, 2015; Kendon, 1967). Por otra parte, los oyentes miran a los oradores la mayor parte del tiempo para indicar interés y atención (Ho et al., 2015; Kendon, 1967). En consonancia con esto, se ha comprobado que los participantes típicos dirigen más la mirada a la cara del interlocutor cuando están escuchando que cuando hablan (Cañigueral y Hamilton, 2019a; Freeth y Bugembe, 2019; Mansour y Kuhn, 2019; Vabalas y Freeth, 2016; Von dem Hagen y Bright, 2017). En conjunto, estos hallazgos ilustran cómo en las interacciones comunicativas en vivo planificamos nuestros movimientos oculares en relación con las señales sociales que se intercambian con nuestra pareja, combinando así las funciones de percepción y señalización de la mirada.
La mirada en el autismo
El autismo es una condición del desarrollo neurológico caracterizada por dificultades en la interacción interpersonal y la comunicación (Asociación Psicológica Americana, 2013). Un rasgo distintivo del autismo es el comportamiento anormal de la mirada en los niños (Zwaigenbaum y otros, 2005), pero las pruebas en los adultos autistas son contradictorias: algunos estudios que utilizan imágenes y vídeos como estímulo sugieren que los adultos autistas evitan el contacto visual, mientras que otros muestran que tienen patrones de mirada típicos (Chita-Tegmark, 2016; Falck-Ytter & Von Hofsten, 2011; Von dem Hagen & Bright, 2017). Si bien las atipicidades en el comportamiento autista de la mirada se han relacionado anteriormente con un menor interés individual en las interacciones sociales (teoría de la motivación social: Chevallier y otros, 2012), propuestas recientes sugieren que las dificultades sociales en el autismo son el resultado de perturbaciones a nivel interpersonal, es decir, en la sintonía mutua de las señales de cada uno durante los intercambios sociales dinámicos (hipótesis de desatención dialéctica: Bolis y otros, 2018). Así pues, para comprender plenamente los mecanismos cognitivos que subyacen a las dificultades sociales en el autismo, es necesario estudiar el comportamiento de la mirada en las interacciones en vivo, en las que las pautas de la mirada resultan de la interacción de sus funciones de percepción y señalización.
Son escasos los estudios sobre el comportamiento de la mirada de las personas autistas durante las interacciones en vivo. Hasta donde sabemos, ningún estudio ha comparado sistemáticamente los patrones de la mirada de personas autistas diagnosticadas clínicamente en interacciones en vivo con los de interacciones pregrabadas, por lo que se desconoce hasta qué punto planifican los movimientos oculares para señalar información a los demás. No obstante, un estudio reciente (Von dem Hagen & Bright, 2017 Experimento 1) encontró que, mientras que los participantes típicos con rasgos autistas bajos dirigían menos la mirada a un video que creían que estaba en vivo que a un video-clip pregrabado, esta diferencia estaba ausente en los participantes típicos con rasgos autistas altos. Esto sugiere que los individuos autistas podrían no utilizar la función de señalización de la mirada.
Una cuestión conexa es si las personas autistas coordinan la mirada con otras señales sociales (por ejemplo, el habla) durante los intercambios comunicativos en vivo. Sólo un estudio ha examinado los patrones de la mirada de adultos autistas típicos frente a los diagnosticados clínicamente durante la conversación (Freeth & Bugembe, 2019), y dos estudios han comparado adultos típicos con rasgos autistas bajos frente a los altos (Vabalas & Freeth, 2016; Von dem Hagen & Bright, 2017 Experimento 2). Mediante el uso de tareas de preguntas y respuestas sobre la alimentación de vídeo en línea o interacciones cara a cara, estos estudios informan que los adultos típicos/de rasgos bajos y los autistas/de rasgos altos siguen patrones de mirada similares cuando alternan entre los roles de hablante y de oyente. Sin embargo, también se ha comprobado que los adultos con rasgos autistas altos pasan menos tiempo mirando a un confederado en vivo que los participantes con rasgos autistas bajos (independientemente del estado del hablante o del oyente) (Von dem Hagen & Bright, 2017 Experimento 2), en particular en la región de los ojos (Hessels y otros, 2018). Podría ser que a los individuos autistas les resulte difícil seguir la dinámica espacio-temporal de las interacciones sociales en vivo (Bolis et al., 2018; Cañigueral & Hamilton, 2019b): esto podría imponer mayores exigencias cognitivas, lo que a su vez reduce la mirada dirigida a los rostros. El estudio de la forma en que se desarrollan los patrones de la mirada de las personas típicas y autistas a lo largo del tiempo y en relación con otras señales sociales podría dar lugar a una mayor comprensión de cuáles son los componentes cognitivos de la planificación de la mirada que se ven comprometidos en el autismo.
El presente estudio
Este trabajo investiga cómo los patrones típicos y autistas de la mirada se modulan por (1) la creencia en ser observado y (2) el potencial para mostrar la verdadera dirección de la mirada (es decir, si la dirección de la mirada real coincide con la dirección de la mirada percibida). Los estudios anteriores se han centrado en los efectos relacionados con la creencia en ser observado comparando los vídeos pregrabados con las interacciones entre videollamadas/cara a cara, lo que proporciona una prueba clara de la función de señalización de la mirada. Sin embargo, se ha prestado poca atención a la posibilidad de mostrar la verdadera dirección de la mirada. Esto es particularmente interesante en el contexto de las videollamadas, que se utilizan cada vez más en estudios de investigación para simular interacciones sociales en vivo. Debido a la posición de la cámara de vídeo, en las videoconferencias hay un desajuste entre la dirección de la mirada verdadera y la percibida: esto puede limitar la función de señalización de la mirada porque se percibirá que no está plenamente coordinada con otras señales sociales (por ejemplo, el habla). Así pues, la comparación de las videollamadas con las interacciones cara a cara permite manipular aspectos más sutiles de la función de señalización de la mirada, y también puede informar sobre la validez externa de las conclusiones obtenidas en los montajes de videollamadas.
En dos estudios se ensayó una muestra de participantes típicos (Estudio piloto; véase el material complementario S1) y una muestra de participantes típicos y autistas emparejados (Estudio sobre el autismo; véase el presente estudio). En cada estudio, los participantes se dedicaron a una tarea de preguntas y respuestas habladas con un confederado (actor profesional) en tres contextos sociales diferentes: Vídeo (videoclips pregrabados del confederado: la mirada sólo tiene una función de percepción), Videollamada (videollamada en vivo con el confederado: la mirada tiene funciones de percepción y señalización limitadas) y Real (interacción en vivo con el confederado: la mirada tiene funciones de percepción y señalización completas). Estos contextos sociales diferían en la creencia de los participantes en ser observados y en su potencial para mostrar la verdadera dirección de la mirada, lo que creaba niveles gradualmente crecientes de validez ecológica (figura 1 a)).

Figura 1. Diseño del estudio: a) diseño experimental y fotografías de muestra de las condiciones, tanto para el Estudio Piloto como para el Estudio del Autismo; b) calendario para un ensayo en la condición de Video.
A través de los tres contextos sociales, grabamos las miradas de los participantes usando rastreadores oculares. Primero analizamos los datos de la mirada agregados a través de toda la tarea para cada condición. Basándonos en nuestros hallazgos en el Estudio Piloto, esperábamos que los participantes típicos dirigieran menos la mirada hacia el confederado en las condiciones de video llamada y real en comparación con la condición de video. No predijimos ninguna diferencia entre las condiciones de VideoCall y Real, ya que nuestra sutil manipulación para la dirección de la mirada verdadera es probablemente difícil de capturar usando medidas agregadas. Además, si los individuos autistas no planean el comportamiento de la mirada para enviar señales (Von dem Hagen & Bright, 2017 Experimento 1), no deberíamos encontrar diferencias entre las condiciones para el grupo autista. También esperábamos que la proporción de mirada dirigida al confederado fuera menor en el grupo autista en comparación con el grupo típico para todas las condiciones (Von dem Hagen & Bright, 2017 Experimento 2).
Luego estudiamos la dinámica de la mirada en relación con el habla en las diferentes condiciones. En línea con estudios anteriores (Freeth & Bugembe, 2019; Vabalas & Freeth, 2016; Von dem Hagen & Bright, 2017 Experimento 2), predijimos que tanto los participantes típicos como los autistas dirigirían más la mirada al confederado cuando escuchaban que cuando hablaban. Basándonos en nuestros hallazgos en el estudio piloto, también predijimos que, si este efecto estaba estrictamente relacionado con la regulación de la toma de turnos, sólo sería cierto para la videollamada y las condiciones reales. Sin embargo, si las demandas cognitivas asociadas a la percepción de los rostros (Beattie, 1981; Glenberg et al., 1998; Markson & Paterson, 2009) modulan la planificación de la mirada mientras se habla, el efecto sería cierto para las tres condiciones. El estudio piloto también reveló que los participantes típicos miraban menos al confederado al principio y al final de los ensayos en las condiciones de videollamada y real, en comparación con la condición de vídeo, probablemente para reducir la excitación. Debido a que en el estudio sobre el autismo teníamos información más precisa sobre el tiempo de los turnos, esperábamos ver también un efecto similar durante la toma de turnos, probablemente relacionado con la regulación de la conversación. Además, predijimos que los participantes autistas no mostrarían tales diferencias entre las condiciones o con el tiempo.
Finalmente, realizamos un análisis exploratorio del movimiento facial de los participantes. Estudios previos han encontrado que los participantes hacen más despliegues faciales cuando están siendo observados (Chovil, 1991b; Fridlund, 1991; Hietanen et al., 2019), sugiriendo un papel para los despliegues faciales en la comunicación (Chovil, 1991a; Crivelli & Fridlund, 2018). Probamos si los participantes típicos mueven más su cara cuando son observados y mientras hablan en comparación con los que escuchan. Un reciente meta-análisis también ha encontrado que los participantes autistas son menos propensos a producir espontáneamente despliegues faciales (Trevisan et al., 2018), por lo que esperábamos que el grupo autista no mostrara diferencias en el movimiento facial entre las condiciones o ventanas de tiempo, y que hiciera menos despliegues faciales que el grupo típico.
Materiales y métodos
Los participantes y el confederado
El estudio piloto mostró un gran tamaño de efecto y potencia para el efecto principal de la condición en la mirada dirigida a los ojos del confederado (n2p≈0.2 y potencia ≈ 0.9 para los análisis tanto agregados como de curso temporal). En el caso del Estudio sobre el autismo, un análisis de la potencia indicó un tamaño de muestra necesario de 26 participantes por grupo (es decir, un total de 52 participantes) para un tamaño de efecto y potencia similares. Así pues, se reclutó un grupo de 26 adultos típicos y 26 adultos autistas de alto funcionamiento utilizando la base de datos sobre el autismo de la institución del autor. Ambos grupos fueron emparejados en cuanto a edad, género, destreza manual y cociente de inteligencia (IQ; WAIS-III Reino Unido, Wechsler, 1999a, 1999b), pero difirieron en cuanto al cociente de autismo (AQ; Baron-Cohen y otros, 2001) (véase la tabla 1). No se registraron datos específicos sobre el origen étnico, la situación socioeconómica y los niveles de educación. Nótese que nos referimos al grupo de autistas como de alto funcionamiento, ya que las capacidades cognitivas y verbales de los participantes estaban por encima del rango típico (es decir, un coeficiente intelectual superior a 80). El reclutamiento de los participantes autistas se basó en el diagnóstico de un clínico independiente, ya sea como Síndrome de Asperger (N = 21) o como Trastorno del Espectro de Autismo (N = 5). Los participantes también fueron examinados en el módulo 4 del Programa de Observación Diagnóstica del Autismo (ADOS) (Lord et al., 2000) por un investigador capacitado: 10 participantes cumplían la clasificación ADOS para el autismo, 10 para el espectro de autismo y 6 no cumplían ninguna clasificación, pero los 6 participantes tenían un diagnóstico claro de un clínico independiente.
Tabla 1. Comparación de grupos típicos y autistas.

El confederado era un actor profesional (edad de actuación: 23-29 años) contratado durante toda la duración del estudio para asegurar una actuación consistente entre los ensayos y los participantes. No conocía los objetivos e hipótesis del estudio, y los participantes creían que era un estudiante que ayudaba en el estudio. Todos los participantes y el confederado dieron su consentimiento informado por escrito y fueron compensados por su participación en el estudio. El estudio recibió la aprobación ética del Comité de Ética de la Investigación local.
Tarea y estímulos
Los participantes completaron una tarea de preguntas y respuestas con el confederado. Creamos un conjunto de preguntas para cada condición experimental (video, videoCall y real). Cada conjunto comprendía 10 preguntas sobre preferencias personales en situaciones diarias neutras o prosociales (por ejemplo: Vas a ir al cine esta noche. ¿Prefieres: opción A, ver una película de fantasía, u opción B, ver una película de comedia?). Los tres conjuntos fueron emparejados para el número de preguntas que describen situaciones neutrales o prosociales. Ver Materiales Suplementarios (S2) para la lista completa de preguntas usadas en el Estudio del Autismo.
Para cada prueba, un solo tono indicaba el comienzo de la fase de preguntas. El confederado leía una pregunta de una tarjeta pero miraba brevemente a la cara de los participantes (cámara web en las condiciones de Video y Videollamada) cuando decía "Opción A" y "Opción B" para captar la atención de los participantes. Después de leer la pregunta, el confederado miró fijamente al participante/cámara web y sostuvo la tarjeta, que tenía las dos opciones escritas en el lado visible para los participantes. Así comenzó la fase de respuesta, en la que se pidió a los participantes que indicaran en una escala del 1 al 8 cuánto preferían esa opción a la otra (1 = preferir fuertemente A; 8 = preferir fuertemente B), y que añadieran más explicaciones sobre por qué preferían esa opción. Los participantes expresaron sus opciones y explicaciones hasta que escucharon tres tonos consecutivos que indicaban el final de la fase de respuesta. Durante la fase de Respuesta, el confederado miró fijamente a la cara de los participantes (cámara web en las condiciones de Video y VideoCall) y mostró una sonrisa cortés. La fase de preguntas duró unos 22 s, y la de respuestas 18 s, por lo que cada ensayo tuvo una duración de unos 40 s. Hubo un breve período de descanso de 5 s entre los ensayos. Véase la figura 1(b) para la cronología de un ensayo de muestra.
Procedimiento experimental
Los participantes completaron la tarea en tres condiciones experimentales: video, videoCall y real (ver Figura 1(a)). En la condición Video (V), los participantes observaron videos pregrabados del confederado mientras estaban solos en la sala de pruebas. Los participantes sabían que el confederado no podía verlos y que no había posibilidades de mostrar la verdadera dirección de la mirada, lo que daba lugar a una interacción poco válida desde el punto de vista ecológico en la que la mirada sólo tiene una función de percepción. En el caso de la condición de videollamada (C), los participantes estaban solos en la sala e interactuaban con el confederado mediante un software de videollamada de libre acceso (Zoom). Los participantes sabían que el confederado podía observarlos, pero no había posibilidades de mostrar la verdadera dirección de la mirada (la posición de la cámara de vídeo significa que hay un desajuste entre la verdadera dirección de la mirada y la dirección percibida de la mirada). Esto dio lugar a una interacción moderada y ecológicamente válida, en la que la mirada tiene funciones de percepción y señalización (limitadas). En la condición Real (R), los participantes y el confederado se encontraban en la misma habitación, sentados al otro lado de una mesa y enfrentados entre sí. Los participantes sabían que el confederado podía observarlos y que había posibilidades de mostrar la verdadera dirección de la mirada, lo que daba lugar a una interacción de alta validez ecológica en la que la mirada tiene funciones de percepción y de señalización (plenas). En todas las condiciones, el confederado llevaba puesto un rastreador ocular y aparecía frente a un fondo plano neutral.
Cada condición experimental se asoció con el mismo conjunto de preguntas para todos los participantes (Conjunto 1 - Vídeo; Conjunto 2 - Videollamada; Conjunto 3 - Real). En el Estudio Piloto, contrarrestamos el orden de las condiciones experimentales. Dado que no hubo efecto de orden, en el Estudio sobre el Autismo, sólo usamos dos condiciones de contrapeso (C-V-R y R-V-C) que dieron a los participantes un "descanso" entre las dos interacciones en vivo (menos abrumador para los participantes autistas). La duración total del estudio fue de alrededor de 45 minutos.
Al final del estudio, todos los participantes completaron un cuestionario posterior a la prueba en el que indicaron en una escala de 0 (en desacuerdo) a 8 (de acuerdo) cuán natural y recíproca era la interacción con el confederado en cada condición. Los participantes también indicaron qué interacción les gustaba más y menos, y cuál pensaban que era el propósito del experimento (las respuestas de 11 participantes típicos y 12 autistas se acercaban al propósito del estudio, por ejemplo, "medir los movimientos oculares al ver un vídeo o interactuar con una persona real", pero ninguno de ellos adivinó el significado de nuestra manipulación o nuestras predicciones específicas). Véase el material complementario (S3) para el cuestionario completo. Después, el experimentador informó a los participantes sobre el propósito real del estudio.
Adquisición y procesamiento de datos
Los participantes se sentaron a un lado de la mesa con un oclusor de cartón. El oclusor enmascaraba todo, excepto una ventana cuadrada de 14″ frente al participante (véase la figura 1). Durante las condiciones de la videoconferencia y la videollamada, se colocó un monitor 14″ en la ventana. Durante la condición Real, el confederado se sentó al otro lado de la mesa y su cara y la mitad superior del cuerpo era visible para los participantes a través de la ventana. Esta disposición aseguró que el confederado tuviera un aspecto similar en las tres condiciones (véase la figura 1 a)).
Se utilizaron dos rastreadores oculares portátiles (Pupil Core monocular, Pupil Labs, Alemania) para registrar los movimientos oculares de los participantes y del confederado. Los datos de seguimiento ocular del confederado se grabaron sólo para las condiciones de VideoCall y Real, pero estas grabaciones tenían una calidad de señal pobre y no se utilizaron para los análisis. El sistema Pupil Core utiliza una cámara "mundial" montada en la cabeza para grabar el entorno, y una cámara "pupilar" montada en la cabeza para seguir los movimientos de la pupila derecha a una frecuencia de 120 Hz (con una muestra reducida a 30 Hz para que coincida con la frecuencia de fotogramas de la cámara "mundial"). En las condiciones de vídeo y videollamada, los participantes se sentaron a unos 60 cm del monitor y pasaron por una rutina de calibración basada en una pantalla de 9 puntos al comienzo de cada condición (1-2 min). En la condición Real, los participantes se sentaron a aproximadamente 100 cm del confederado y pasaron por una rutina de calibración manual de 6 puntos al comienzo de esta condición (1-2 min). Después de la adquisición de datos, los vídeos de la cámara "mundial" de los participantes se procesaron posteriormente con OpenFace (Baltrusaitis et al., 2016) para detectar las coordenadas de los puntos de referencia faciales en la cara del confederado. Estos puntos de referencia faciales se utilizaron para crear dos regiones de interés (ROI) que correspondían a las mitades superior (región de los ojos) e inferior (región de la boca) de la cara, definidas como las mitades superior e inferior de una elipse que se ajustó para rastrear la ubicación y la orientación de la cara del confederado durante la tarea.
Para rastrear el movimiento facial, se dispuso una cámara web para grabar datos de la cara del participante (Logitech; velocidad de grabación de 20 Hz). Las grabaciones se procesaron mediante el algoritmo OpenFace, que utiliza el Sistema de Codificación de Acción Facial (FACS; Ekman & Friesen, 1976) para taxonizar los movimientos de los músculos faciales y deconstruir las pantallas faciales en unidades de acción específicas (UA). OpenFace puede reconocer un subconjunto de 18 unidades de acción facial y proporciona información sobre la presencia o ausencia de cada una de estas unidades de acción facial para cada fotograma de la grabación de vídeo.
Para controlar los efectos de movimiento facial relacionados con la producción de discurso, se utilizaron dos micrófonos de solapa para grabar el discurso de los participantes y del confederado. Los micrófonos también nos permitieron implementar un sistema disparador de audio para detectar con precisión la toma de turnos. Las grabaciones de audio fueron procesadas con un programa personalizado que detectaba quién hablaba con el tiempo. Nótese que no hubo diferencias generales en la cantidad de discurso de los participantes en las distintas condiciones (véase el Material Complementario S4).
Realizamos análisis agregados y de tiempo de curso de la mirada y el movimiento facial (véase la sección "Resultados" para más detalles sobre estos análisis). Véase la figura 2 para un diagrama con una visión general del proceso de adquisición, procesamiento y análisis de datos.
Figura 2

Resultados
Comprobación de la manipulación: calificaciones del cuestionario después de la prueba
Para comprobar si nuestra manipulación experimental fue eficaz, para cada rasgo del cuestionario posterior a la prueba (naturalidad y reciprocidad) realizamos un análisis de medidas repetidas en dos direcciones de la varianza (ANOVA) con la calificación media como variable dependiente, la condición como factor dentro del sujeto y el grupo como factor entre sujetos. En la tabla 2 se describen las calificaciones del cuestionario posterior a la prueba.
Tabla 2. Descripciones de las calificaciones de los cuestionarios posteriores a la prueba en el estudio del autismo.

Para ambos rasgos, encontramos un efecto principal del Grupo (naturalidad: F(1,50) = 4,69, p = 0,035, n2p=0,086; reciprocidad: F(1,50) = 4,03, p = 0,05, n2p=0,075): el grupo de autismo percibía al confederado como más natural y recíproco que el Grupo Típico (Figura 3). En cuanto a la naturalidad, hubo un efecto principal de la Condición, F(2,100) = 3,68, p = 0,04, n2p=0,069, pero no hubo efectos en las comparaciones post hoc por pares (Figura 3(a)). En cuanto a la reciprocidad, hubo un efecto principal de la Condición, F(2,100) = 37.8, p < 0.001, n2p=0.431: el confederado fue percibido como más recíproco en la Videollamada en comparación con la Condición de Video, t(51) = 5.64, p < 0.001, dz = 0. 782; más recíproco en el Real comparado con la condición de Video, t(51) = 6.94, p < 0.001, dz = 0.962; y más recíproco en el Real comparado con la condición de VideoCall, t(51) = 3.93, p < 0.001, dz = 0.544 (Figura 3(b)). No hubo un efecto de interacción significativo entre la Condición y el Grupo para ninguno de los rasgos.

Figura 3. Resultados de las clasificaciones y análisis agregados de la mirada en el Estudio del Autismo: a) Calificaciones de naturalidad; b) Calificaciones de reciprocidad; c) Proporción de tiempo de observación en la región ocular para cada condición y grupo; d) Proporción de tiempo de observación en la región bucal para cada condición y grupo; y e) Número de unidades de observación facial para cada condición y grupo. Media (círculo relleno), SE (barras de error) y frecuencia de los valores (ancho de la distribución). Los asteriscos significan diferencia en p < 0,05 (*), p < 0,01 (**) y p < 0,001 (***). V: Vídeo; C: Videollamada; R: Real.
Análisis agregados
Para investigar los patrones generales de la mirada y el movimiento facial en las tres condiciones, hemos agregado los datos de todos los puntos de tiempo y pruebas para cada condición. La tabla 3 da una descripción de estas medidas.
Tabla 3. Descripciones de los análisis agregados en el Estudio del Autismo.

Para la mirada, realizamos un ANOVA de medidas repetidas en dos direcciones con una proporción media de tiempo de mirada a cada ROI (región de los ojos y la boca) como variable dependiente, Condición como factor dentro del sujeto y Grupo como factor entre sujetos. Para la mirada dirigida a la región de los Ojos, hubo un efecto principal de la Condición, F(2,100) = 9.98, p < 0.001, n2p=0.166. Los participantes miraron más a la región de los Ojos del confederado en el Video comparado con la condición de la Videollamada, t(51) = 3,76, p = 0,001, dz = 0,522, y en el Video comparado con la condición Real, t(51) = 3,35, p = 0,006, dz = 0,465, pero no hubo diferencias entre las condiciones de la Videollamada y la Real, t(51) = 0,583, p > 0,05, dz = 0,081 (Figura 3(c)). Ningún otro efecto principal o de interacción fue significativo.
En el caso de la mirada dirigida a la región de la Boca, hubo un efecto principal de Condición, F(2.100) = 3,81, p = 0,025, n2p=0,071: los participantes tendieron a mirar menos a la región de la Boca del confederado en la Videollamada en comparación con la condición de Video, t(51) = 2. 41, p = 0,052, dz = 0,334, pero no hubo diferencias entre las condiciones de Video y las Reales, t(51) = 2,13, p > 0,05, dz = 0,295, y entre la VideoLlamada y las condiciones Reales, t(51) = 0,600, p > 0,05, dz = 0,083 (Figura 3(d)). Ningún otro efecto principal o de interacción fue significativo.
Para el movimiento facial, ajustamos un ANOVA multinivel con el número medio de UA faciales como variable dependiente, el participante como factor aleatorio (intercepción aleatoria), el habla como factor aleatorio (pendiente aleatoria) y la condición, el grupo y el habla como factores fijos. Este análisis incluyó 1560 puntos de datos (2 grupos, 26 participantes/grupo, 3 condiciones/participante, 10 ensayos/condición). Hubo un efecto principal de la Condición, F(2.1512,0) = 12,54, p < 0,001: los participantes movieron más su cara en el Real en comparación con la condición del Video, t(1516,2) = 3,44, p = 0,001, dz = 0. 039, pero no hubo diferencias entre la condición de VideoCall comparada con la condición de Video, t(1513.8) = 1.60, p > 0.05, dz = 0.018, o entre la condición de VideoCall y la Real, t(1506.2) = 1.84, p > 0.05, dz = 0.021 (Figura 3(e)). Ningún otro efecto principal o de interacción fue significativo.
Análisis de tiempo-curso
Para estudiar más detalladamente las dinámicas de los comportamientos sociales, observamos la mirada y los patrones de movimiento facial a lo largo de cinco ventanas de tiempo en el ensayo: comienzo de la pregunta/interacción (0-10 s), fin de la pregunta (10-22 s), toma de turnos (22-24 s), comienzo de la respuesta (24-32 s) y fin de la respuesta/interacción (32-40 s). Para la mirada ocular, los cursos de tiempo se suavizaron utilizando un filtro de media móvil de 1 s. Para cada medida (mirada ocular a Ojos y Boca, y movimiento facial), ajustamos el mismo ANOVA que en el análisis agregado y añadimos Ventana de tiempo como un factor dentro del tema. El ANOVA multinivel para el movimiento facial ahora incluía 7800 puntos de datos (2 grupos, 26 participantes/grupo, 3 condiciones/participante, 10 ensayos/condición, 5 ventanas temporales/ensayo). Aunque utilizamos los datos de las ventanas de tiempo para los análisis estadísticos, los datos del curso completo del tiempo se muestran en gráficos. En la tabla 4 se presentan descripciones del grupo típico y en la tabla 5 se presentan descripciones del grupo de autismo. A continuación, informamos de nuestros principales hallazgos; para los resultados completos y las pruebas post hoc, véase la Tabla S1 (para la mirada) y la Tabla S2 (para el movimiento facial).
Tabla 4. Descripciones de los análisis de tiempo-recorrido del grupo típico en el estudio del autismo y descripciones de los análisis de tiempo y curso del grupo típico en el estudio del autismo.

Tabla 5. Descripciones de los análisis de tiempo y curso del grupo de autismo en el Estudio del Autismo.

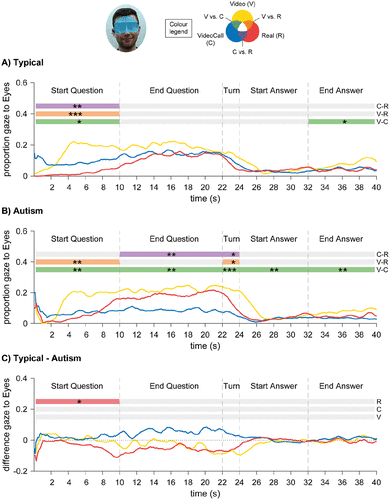
Para la mirada dirigida a la región de los Ojos del confederado, hubo un efecto principal de la Condición, F(2,100) = 10.4, p < 0.001, n2p=0.172, y un efecto principal de la Ventana de Tiempo, F(4,200) = 39.7, p < 0.001, n2p=0.443: los participantes miraron más a los ojos del confederado en el Video que en la VideoLlamada y las condiciones Reales, y durante las fases de Pregunta que durante las fases de Toma de Turno y Respuesta. Hubo un efecto de interacción entre la Condición y la Ventana de Tiempo, F(8,400) = 5.55, p < 0.001, n2p=0.100, y una interacción entre la Condición, la Ventana de Tiempo y el Grupo, F(8,400) = 2.81, p = 0.028, n2p=0.053. Al comienzo de la fase de Pregunta, ambos grupos miraban menos a la región de los Ojos en las condiciones de la Videollamada y Real (en comparación con el Video), y al final de la fase de Respuesta miraban menos en la condición de la Videollamada (ver Figura 4(a) y (b)). Las diferencias entre los grupos en la condición Real revelaron que, al comienzo de la fase de Preguntas, el grupo Típico miraba menos a la región de los Ojos que el grupo de Autismo (ver Figura 4(c)). Ningún otro efecto principal o de interacción fue significativo.
Figura 4. Resultados de los análisis de tiempo de la mirada dirigida a la región de los ojos en el Estudio del Autismo: a) Grupo típico; b) Grupo de autismo. c) Diferencia entre el grupo típico y el grupo de autismo: los valores positivos indican Típico > Autismo, y los valores negativos indican Autismo > Típico. Los asteriscos significan diferencia en p < 0,05 (*), p < 0,01 (**) y p < 0,001 (***).
Para la mirada dirigida a la región de la Boca del confederado, hubo un efecto principal de la Condición, F(2,100) = 4.83, p = 0.01, n2p=0.088, y un efecto principal de la Ventana de Tiempo, F(4,200) = 38.7, p < 0.001, n2p=0.437: los participantes miraron más a la boca del confederado en la Condición de Vídeo que en la Condición de Videollamada, y durante la fase de Preguntas que durante la fase de Turnos y Respuestas. Hubo un efecto de interacción entre la Condición y la Ventana de Tiempo, F(8,400) = 4.86, p = 0.002, n2p=0.089. Para ambos grupos, al comienzo de la fase de Preguntas los participantes miraron menos a la región de la Boca en la condición Real (comparado con la VideoLlamada y el Video), y miraron menos a la Toma de turnos y al comienzo de la fase de Respuesta en la VideoLlamada y las condiciones Reales (comparado con el Video) (ver Figura 5(a) y (b)). Ningún otro efecto principal o de interacción fue significativo.
Figura 5. Resultados de los análisis de tiempo de la mirada dirigida a la región de la boca en el estudio del autismo: a) Grupo típico; b) Grupo de autismo. c) Diferencia entre el grupo típico y el grupo de autismo: los valores positivos indican típico > autismo, y los valores negativos indican autismo > típico. Los asteriscos significan diferencia en p < 0,05 (*), p < 0,01 (**) y p < 0,001 (***).

En cuanto al movimiento facial, hubo un efecto principal de la Condición, F(2,7657.5) = 59.0, p < 0.001, y un efecto principal de la Ventana de Tiempo, F(4,7669.2) = 76.0, p < 0.001: los participantes movieron su cara más en la condición Real que en la condición de Video, y durante la fase de Respuesta que durante la fase de Pregunta y Toma de turnos (ver Figura 6(a) y (b)). También hubo un efecto de interacción entre la Condición y la Ventana de Tiempo, F(8,7653.5) = 1.99, p = 0.043, pero no hubo efectos en las comparaciones post hoc por pares. Ningún otro efecto principal o de interacción fue significativo.
Figura 6. Resultados de los análisis del curso del tiempo de los movimientos faciales en el estudio del autismo: a) Grupo típico; b) Grupo de autismo. c) Diferencia entre el grupo típico y el grupo de autismo: los valores positivos indican Típico > Autismo, y los valores negativos indican Autismo > Típico. Los asteriscos significan diferencia en p < 0,05 (*), p < 0,01 (**) y p < 0,001 (***).

Discusión
Investigamos cómo los patrones típicos y autistas de la mirada son modulados por la creencia en ser observado y el potencial para mostrar la verdadera dirección de la mirada durante una tarea de preguntas y respuestas. También realizamos un análisis exploratorio para probar estos efectos en los patrones de movimiento facial. Contrariamente a lo que esperábamos, los participantes típicos y autistas mostraron una modulación similar de la mirada y de los despliegues faciales: miraban menos al confederado y producían más despliegues faciales cuando eran observados y cuando hablaban. Sin embargo, al comienzo de la interacción cara a cara, los participantes autistas miraban más a los ojos del confederado que los participantes típicos. Estos hallazgos desafían los estudios anteriores que informaban de un comportamiento de mirada atípico en el autismo.
Señalización social en individuos típicos
Para investigar los patrones generales de la mirada, agregamos los datos a través de los cursos de tiempo para cada condición. Repitiendo el Estudio Piloto, los participantes miraron menos a los ojos del confederado en las condiciones de Real y VideoCall en comparación con la condición de Video. Estos resultados son coherentes con estudios anteriores que muestran que los participantes miran menos a una pareja en vivo que a un video-clip de la misma pareja, ya sea que estén interactuando activamente (Cañigueral & Hamilton, 2019a) o no (Laidlaw et al., 2011). El patrón similar de mirada a los ojos en las condiciones de VideoCall y Real también sugiere que los participantes pudieron resolver el desajuste entre la dirección de la mirada verdadera y la percibida en la condición de VideoCall. También encontramos que los participantes tendían a mirar menos a la boca de la pareja en la videollamada que en la condición de video, aunque este efecto no alcanzó la significación.
Para comprender plenamente qué mecanismos cognitivos modulan la planificación de la mirada en las interacciones en vivo, es necesario examinar cómo cambia la mirada a lo largo de la interacción en relación con otras señales, como el habla. De acuerdo con el estudio piloto, encontramos que los participantes miraban más a los ojos y a la boca del confederado durante la fase de preguntas que durante la fase de respuestas. Esto concuerda con estudios anteriores que investigaban la función reguladora de la mirada (Hessels y otros, 2019; Ho y otros, 2015; Kendon, 1967), en los que se descubrió que los participantes miraban más a la pareja cuando escuchaban que cuando hablaban. Sin embargo, esta modulación también se aplicaba a la condición de vídeo, en la que los participantes sabían que el confederado estaba pregrabado. Esto podría indicar que evitamos la mirada mientras hablamos para reducir las demandas cognitivas relacionadas con la mirada de las caras (Beattie, 1981; Glenberg y otros, 1998; Kendon, 1967; Markson y Paterson, 2009). Se necesitarán futuros estudios para aclarar este hallazgo.
De manera similar al estudio piloto, los análisis del curso del tiempo mostraron que los patrones de la mirada a los ojos y de la mirada a la boca en las tres condiciones diferían a lo largo del curso del tiempo del ensayo. Al comienzo de la fase de preguntas, los participantes miraban menos a los ojos y la boca del confederado en las condiciones de vida (VideoCall y Real). El hecho de que los participantes evitaran especialmente la mirada a los ojos cuando podía haber verdadera mirada directa (condición Real) sugiere que durante las interacciones en vivo los participantes evitaron la mirada para reducir la excitación asociada con el contacto visual (Kendon, 1967; Pönkänen y otros, 2011). Otra posibilidad de mayor mirada directa en la condición de Video es que los participantes confiaron más en la lectura de labios para asegurarse de que entendían completamente la pregunta, ya que sólo tuvieron una oportunidad de escucharla (en la VideoLlamada y en la condición Real los participantes podrían haber pedido breves aclaraciones, y el confederado informó que esto sucedió unas pocas veces). Al tomar el turno y comenzar la fase de respuesta, los participantes miraron menos a la boca del confederado en la videoconferencia y en condiciones reales, lo que sugiere que los participantes se retiraron más rápidamente de la boca del confederado en vivo que del confederado pregrabado. Una vez más, esto podría deberse a que la mirada tiene una función reguladora (por ejemplo, evitar la mirada cuando se empieza a hablar) o a que las caras en vivo son más exigentes desde el punto de vista cognitivo que las caras pregrabadas. El estudio del papel de la carga cognitiva asociada con las caras vivas y las interacciones en vivo puede arrojar algo de luz sobre esta cuestión. Además, los patrones de mirada similares encontrados en las condiciones en vivo indican que los participantes podrían ajustarse a la discrepancia entre la dirección de la mirada verdadera y la percibida en la condición de la videollamada.
Para complementar nuestros hallazgos de la mirada, también observamos los patrones de movimiento facial en las tres condiciones mientras controlábamos los efectos relacionados con la producción del habla. Como en el Estudio Piloto, los participantes movieron su cara más en las condiciones de Real y VideoCall que en la condición de Video durante todo el curso del tiempo, y este efecto fue particularmente marcado durante la toma de turnos. Los participantes también movieron más su cara durante la fase de Respuesta que durante la fase de Pregunta. En línea con estudios anteriores, esto indica que los participantes utilizaron las pantallas faciales como señales sociales (Chovil, 1991b; Crivelli & Fridlund, 2018; Fridlund, 1991; Hietanen et al., 2019).
Señales sociales en personas autistas
Contrariamente a lo que esperábamos, los patrones generales de la mirada a los ojos y la mirada a la boca en el análisis agregado fueron los mismos entre los grupos típicos y los autistas. Hasta donde sabemos, este es el primer estudio que compara sistemáticamente los patrones de la mirada de adultos autistas diagnosticados clínicamente en vivo versus interacciones pregrabadas, y nuestros hallazgos sugieren que la planificación de la mirada en el autismo está modulada tanto por sus funciones de percepción como de señalización. En contraste con estos hallazgos, un estudio anterior (Von dem Hagen & Bright, 2017 Experimento 1) encontró que los participantes típicos con altos rasgos autistas dirigían la mirada por igual a un video en vivo y a un video pregrabado. Una diferencia clave es que en su estudio los participantes no fueron diagnosticados clínicamente como autistas. Podría ser que las personas diagnosticadas clínicamente puedan comprender mejor sus dificultades y mejorar el manejo de su comportamiento social. Esto puede ayudarles a desarrollar estrategias de compensación, es decir, a mostrar una mejor presentación conductual de los síntomas aunque persistan los déficits a nivel cognitivo y neurobiológico (Livingston y Happé, 2017). Otra diferencia es que en el estudio de Von dem Hagen y Bright los participantes no se relacionaron activamente con la persona en el video: estar en un contexto comunicativo explícito, como el del presente estudio, puede ser un indicio para que los participantes autistas utilicen la mirada como señal social.
Para el análisis del curso temporal de la mirada, se encontró que los participantes típicos y los autistas mostraban en general patrones similares de mirada a los ojos y de mirada a la boca. En consonancia con estudios anteriores (Freeth & Bugembe, 2019; Vabalas & Freeth, 2016; Von dem Hagen & Bright, 2017 Experimento 2), ambos grupos miraban más al confederado cuando escuchaban que cuando hablaban. Esto sugiere que los individuos autistas de alto funcionamiento son capaces de modular el comportamiento de la mirada según su papel en la conversación (orador u oyente). Además, al comienzo de la interacción y al tomar turnos, los participantes autistas miraban menos a los ojos y la boca del confederado cuando estaban siendo observados (Videoconferencia o Condición real) que cuando no lo estaban (Condición de vídeo). Esto indica que en las interacciones en vivo los participantes autistas también pueden evitar la mirada para reducir la excitación (Argyle y Dean, 1965; Pönkänen y otros, 2011), para regular la interacción (Kendon, 1967) o para reducir las exigencias cognitivas de mirar las caras (Beattie, 1981; Glenberg y otros, 1998; Markson y Paterson, 2009). Sin embargo, no podemos distinguir si esto refleja una conducta de mirada espontánea o estrategias de compensación (Livingston & Happé, 2017).
La comparación directa entre los patrones de mirada típicos y los autistas reveló que, sólo en la condición real y al comienzo de la fase de preguntas, los participantes autistas dirigían más la mirada a los ojos del confederado que el grupo típico. Esta evidencia pone en tela de juicio estudios anteriores que mostraban que los participantes autistas utilizan la mirada de manera similar a los individuos típicos durante una tarea de Preguntas y Respuestas en vivo (Freeth & Bugembe, 2019; Vabalas & Freeth, 2016; Von dem Hagen & Bright, 2017 Experimento 2), o que pasan menos tiempo mirando a un confederado en vivo (Hessels et al., 2018; Von dem Hagen & Bright, 2017 Experimento 2). Resulta interesante que dos estudios recientes hayan descubierto que los participantes con rasgos de ansiedad social elevados miran antes y más a las caras al principio de la interacción, en comparación con los participantes con rasgos de ansiedad social bajos (Gregory et al., 2019; Gutiérrez-García et al., 2019). Los autores sugieren que este sesgo atencional podría reflejar estrategias de compensación para anticiparse a las evaluaciones negativas. En nuestro estudio, el sesgo atencional inicial también podría reflejar una estrategia de compensación, en la que los participantes autistas han aprendido que necesitan hacer más contacto visual durante las interacciones cara a cara (Del Bianco et al., 2018; Livingston & Happé, 2017).
En general, nuestros hallazgos sugieren que los individuos autistas no tienen un interés reducido en atender los rostros de otras personas, y que generalmente son capaces de ajustar la mirada a las demandas de una conversación estructurada. Esto contradice la teoría de la motivación social (Chevallier et al., 2012) y la hipótesis del desajuste dialectal (Bolis et al., 2018) del autismo. Sin embargo, la posibilidad de que los patrones de la mirada sean ligeramente diferentes en las conversaciones espontáneas y que los participantes autistas estén utilizando estrategias de compensación hace difícil sacar interpretaciones concluyentes de nuestros hallazgos. Será necesario seguir investigando para aclarar si los patrones de la mirada en las interacciones espontáneas cara a cara apoyan cada una de estas teorías y cómo lo hacen.
Finalmente, examinamos los patrones de movimiento facial en individuos autistas. A diferencia de estudios anteriores (Trevisan et al., 2018), tanto los análisis agregados como los análisis del curso del tiempo no arrojaron diferencias entre los grupos típicos y los autistas: los participantes autistas también mostraron más movimiento facial al ser observados y al hablar, lo que sugiere que utilizan las exhibiciones faciales como señal social (Chovil, 1991a; Crivelli & Fridlund, 2018). Una limitación de este hallazgo es que no tenemos información sobre el contenido de las exhibiciones faciales: estudiar si las exhibiciones faciales son significativas o no para el mensaje hablado será una cuestión interesante para futuras investigaciones.
Limitaciones e investigaciones futuras
Una de las principales limitaciones de nuestro estudio es que la tarea que utilizamos estaba muy estructurada y echaba de menos la continuidad de las conversaciones naturales. Aunque tanto los participantes típicos como los autistas calificaron a los confederados como cada vez más recíprocos entre las condiciones de Video, VideoCall y Real, no hubo diferencias en las calificaciones de naturalidad. Además, algunas de nuestras conclusiones (por ejemplo, evitar la mirada al principio y al final de las interacciones en vivo, no hubo diferencias generales entre los grupos típicos y los autistas) podrían explicarse por la naturaleza estructurada de nuestra tarea. De manera similar, nuestro montaje experimental utilizó un oclusor, que podría limitar la validez ecológica de nuestros resultados. El uso de una tarea en la que los confederados y los participantes entablan una conversación natural en un marco más válido desde el punto de vista ecológico podría proporcionar una mayor comprensión de cómo se utiliza la mirada en la vida real. No obstante, el hecho de que no haya grandes diferencias en los patrones de la mirada entre la videollamada y las condiciones reales valida el uso de las videollamadas como un escenario fiable para simular las interacciones cara a cara en los estudios de investigación.
Otra limitación es que no pudimos utilizar los datos de seguimiento ocular del confederado, ya que las grabaciones tenían mala calidad de señal, por lo que no pudimos comprobar si los patrones de mirada del confederado eran los mismos para el grupo típico y el autista. Esto también restringe las investigaciones sobre la forma en que se relacionan los patrones de la mirada entre las parejas que interactúan, o el grado de contacto ocular que hacen el confederado y el participante: esto podría proporcionar una mayor comprensión sobre la forma en que utilizan las señales sociales para comunicarse entre sí. Además, nuestra muestra sólo incluía individuos autistas de alto funcionamiento: será importante comprobar hasta qué punto nuestros hallazgos se mantienen a lo largo del espectro.
El presente estudio abre varias preguntas para futuras investigaciones. Por ejemplo, una pregunta interesante es cómo se relacionan los patrones de la mirada con las demandas cognitivas asociadas a la observación de rostros (en vivo) (Beattie, 1981; Glenberg et al., 1998; Markson & Paterson, 2009) o el tema de conversación (Hutchins & Brien, 2016; Nadig et al., 2010). La inclusión de medidas fiables de la latencia de la respuesta (para evaluar la dificultad de la tarea) y de las funciones ejecutivas podría contribuir a aclarar esta cuestión. Otra pregunta para futuras investigaciones es en qué medida los individuos autistas utilizan estrategias de compensación para orientar el comportamiento de la mirada durante las interacciones sociales (Livingston y Happé, 2017). Aquí hemos demostrado cómo el uso del análisis del curso del tiempo es útil para señalar diferencias específicas entre los grupos típicos y los autistas (por ejemplo, al comienzo de la interacción). El diseño de paradigmas más elaborados en entornos ecológicamente válidos y el uso de análisis más finos podrían ayudar a identificar qué componentes cognitivos del procesamiento de la mirada se ven alterados en el autismo. Por último, nuestros resultados muestran que, aunque los participantes mostraron patrones de mirada similares en las condiciones de la videollamada y la real, percibieron la condición de la videollamada como menos recíproca que la real. Esto plantea la pregunta de qué es lo que da un sentimiento de reciprocidad en las interacciones cara a cara. Sugerimos que los retrasos en la conexión de la videollamada probablemente obstaculizan aspectos sutiles pero fundamentales de las interacciones cara a cara, por ejemplo, la coordinación interpersonal de los movimientos corporales, aunque se necesitarán futuros estudios para aclarar esta cuestión.
Conclusión
En el presente estudio se investigó cómo el comportamiento de la mirada en individuos típicos y autistas se modula por la creencia en ser observado y la posibilidad de mostrar la verdadera dirección de la mirada. Contrariamente a nuestras hipótesis, los patrones de la mirada fueron en general similares en los grupos típicos y autistas: ambos grupos miraban menos al confederado cuando eran observados y cuando hablaban. Sin embargo, al comienzo de una interacción cara a cara, los participantes autistas miraban más a los ojos del confederado que los participantes típicos. Un análisis exploratorio también sugirió que ambos grupos utilizaban las muestras faciales como señal social. Estas conclusiones indican que el uso de señales sociales en el autismo está menos comprometido que lo que se había informado anteriormente.
Agradecimientos
Los autores quieren agradecer a Shannon Rewcroft por su papel de actriz profesional en el Estudio Piloto, y a Tea Poldevaart por su papel de actor profesional en el Estudio del Autismo.
El cumplimiento de las normas éticas
Todos los procedimientos fueron aprobados por el Comité de Ética de la Investigación de la UCL y estuvieron de acuerdo con la Declaración de Helsinki y las normas éticas de la APA.
Declaración de intereses en conflicto
El autor o los autores no declararon ningún conflicto de intereses potencial con respecto a la investigación, la autoría y/o la publicación de este artículo.
Financiación
El autor o los autores revelaron haber recibido el siguiente apoyo financiero para la investigación, la autoría y/o la publicación de este artículo: Roser Cañigueral reconoce el apoyo financiero de la Fundación 'la Caixa' (ID 100010434, código de subvención LCF/BQ/EU16/11560039) y del Alan & Nesta Ferguson Trust. Este proyecto fue apoyado por una subvención de inicio del Consejo Europeo de Investigación bajo el código 313398-INTERACT (PI A.H.) y el Leverhulme Trust bajo el código de subvención RPG-2016-251 (PI A.H.). Los organismos de financiación no participaron en la ejecución de este estudio y en la redacción del informe.
ORCID iDs
Roser Cañigueral https://orcid.org/0000-0003-2261-1040
Antonia F de C Hamilton https://orcid.org/0000-0001-8000-0219
Material suplementario
El material suplementario para este artículo está disponible en línea.
Cañigueral R, Ward JA, Hamilton AF de C. Effects of being watched on eye gaze and facial displays of typical and autistic individuals during conversation. Autism. August 2020.
doi:10.1177/1362361320951691
Referencias
American Psychological Association . (2013). Diagnostic and statistical manual of mental disorders (5th ed.). American Psychiatric Publishing. Google Scholar | Crossref
Argyle, M., Cook, M. (1976). Gaze and mutual gaze. Cambridge University Press. Google Scholar
Argyle, M., Dean, J. (1965). Eye-contact, distance and affiliation. Sociometry, 28(3), 289–304. https://doi.org/10.2307/2786027 Google Scholar
Baltrusaitis, T., Robinson, P., Morency, L. P. (2016, March 7–10). OpenFace: An open source facial behavior analysis toolkit [Conference session]. 2016 IEEE Winter Conference on Applications of Computer Vision (WACV), Lake Placid, NY, United States. https://doi.org/10.1109/WACV.2016.7477553 Google Scholar
Baron-Cohen, S., Wheelwright, S. J., Skinner, R., Martin, J., Clubley, E. (2001). The autism-spectrum quotient (AQ): Evidence from Asperger Syndrome/high-functioning autism, males and females, scientists and mathematicians. Journal of Autism and Developmental Disorders, 31, 5–17. Google Scholar | Crossref | Medline | ISI
Beattie, G. W. (1981). A further investigation of the cognitive inference hypothesis of gaze patterns during conversation. British Journal of Social Psychology, 20, 243–248. Google Scholar | Crossref | ISI
Bindemann, M., Burton, A. M., Jenkins, R. O. B. (2005). Faces retain attention. Psychonomic Bulletin & Review, 12(6), 1048–1053. Google Scholar | Crossref | Medline
Birmingham, E., Bischof, W. F., Kingstone, A. (2009). Get real! Resolving the debate about equivalent social stimuli. Visual Cognition, 17(6–7), 904–924. https://doi.org/10.1080/13506280902758044 Google Scholar
Bolis, D., Balsters, J., Wenderoth, N., Becchio, C., Schilbach, L. (2018). Beyond autism: Introducing the dialectical misattunement hypothesis and a Bayesian account of intersubjectivity. Psychopathology, 50(6), 355–372. https://doi.org/10.1159/000484353 Google Scholar
Cañigueral, R., Hamilton, A. F. de C. (2019a). Being watched: Effects of an audience on eye gaze and prosocial behaviour. Acta Psychologica, 195, 50–63. https://doi.org/10.1016/j.actpsy.2019.02.002 Google Scholar
Cañigueral, R., Hamilton, A. F. de C. (2019b). The role of eye gaze during natural social interactions in typical and autistic people. Frontiers in Psychology, 10, Article 560. https://doi.org/10.3389/fpsyg.2019.00560 Google Scholar
Chevallier, C., Kohls, G., Troiani, V., Brodkin, E. S., Schultz, R. T. (2012). The social motivation theory of autism. Trends in Cognitive Neuroscience, 16(4), 231–239. https://doi.org/10.1016/j.tics.2012.02.007 Google Scholar
Chita-Tegmark, M. (2016). Research in developmental disabilities review article social attention in ASD : A review and meta-analysis of eye-tracking studies. Research in Developmental Disabilities, 48, 79–93. https://doi.org/10.1016/j.ridd.2015.10.011 Google Scholar
Chovil, N. (1991a). Discourse-oriented facial displays in conversation. Research on Language and Social Interaction, 25(1–4), 163–194. https://doi.org/10.1080/08351819109389361 Google Scholar
Chovil, N. (1991b). Social determinants of facial displays. Journal of Nonverbal Behavior, 15(3), 141–167. Google Scholar | Crossref
Crivelli, C., Fridlund, A. J. (2018). Facial displays are tools for social influence. Trends in Cognitive Sciences, 22(5), 388–399. https://doi.org/10.1016/j.tics.2018.02.006 Google Scholar
Del Bianco, T., Mazzoni, N., Bentenuto, A., Venuti, P. (2018). An investigation of attention to faces and eyes: Looking time is task-dependent in autism spectrum disorder. Frontiers in Psychology, 9, Article 2629. https://doi.org/10.3389/fpsyg.2018.02629 Google Scholar
Efran, J. S. (1968). Looking for approval: Effects on visual behavior of approbation from persons differing in importance. Journal of Personality and Social Psychology, 10(1), 21–25. Google Scholar | Crossref | Medline
Efran, J. S., Broughton, A. (1966). Effect of expectancies for social approval on visual behavior. Journal of Personality and Social Psychology, 4(1), 103–107. https://doi.org/10.1037/h0023511 Google Scholar
Ekman, P., Friesen, W. V. (1976). Measuring facial movement. Environmental Psychology and Nonverbal Behavior, 1(1), 56–75. Google Scholar | Crossref | ISI
Falck-Ytter, T., Von Hofsten, C. (2011). How special is social looking in ASD: A review. In Braddick, O., Atkinson, J., Innocenti, G. M. (Eds.), Progress in brain research: Gene expression to neurobiology and behavior: Human brain development and developmental disorders (1st ed., Vol. 189, pp. 209–222). Elsevier. https://doi.org/10.1016/B978-0-444-53884-0.00026-9 Google Scholar
Foulsham, T., Walker, E., Kingstone, A. (2011). The where, what and when of gaze allocation in the lab and the natural environment. Vision Research, 51(17), 1920–1931. Google Scholar | Crossref | Medline | ISI
Freeth, M., Bugembe, P. (2019). Social partner gaze direction and conversational phase; factors affecting social attention during face-to-face conversations in autistic adults? Autism, 23(2), 503–513. Google Scholar | SAGE Journals | ISI
Fridlund, A. J. (1991). Sociality of solitary smiling: Potentiation by an implicit audience. Journal of Personality and Social Psychology, 60(2), 229–240. Google Scholar | Crossref | ISI
Glenberg, A. M., Schroeder, J. L., Robertson, D. A. (1998). Averting the gaze disengages the environment and facilitates remembering. Memory and Cognition, 26(4), 651–658. https://doi.org/10.3758/BF03211385 Google Scholar
Gobel, M. S., Kim, H. S., Richardson, D. C. (2015). The dual function of social gaze. Cognition, 136, 359–364. Google Scholar | Crossref | Medline | ISI
Goffman, E. (1963). Behavior in public places. Simon & Schuster. Google Scholar
Gregory, N. J., Bolderston, H., Antolin, J. V. (2019). Attention to faces and gaze-following in social anxiety: Preliminary evidence from a naturalistic eye-tracking investigation. Cognition and Emotion, 33(5), 931–942. https://doi.org/10.1080/02699931.2018.1519497 Google Scholar
Gutiérrez-García, A., Fernández-Martín, A., Del Líbano, M., Calvo, M. G. (2019). Selective gaze direction and interpretation of facial expressions in social anxiety. Personality and Individual Differences, 147, 297–305. https://doi.org/10.1016/j.paid.2019.04.034 Google Scholar
Hessels, R. S., Holleman, G. A., Cornelissen, T. H. W., Hooge, I. T. C., Kemner, C. (2018). Eye contact takes two – Autistic and social anxiety traits predict gaze behavior in dyadic interaction. Journal of Experimental Psychopathology, 9(2), 1–17. https://doi.org/10.5127/jep.062917 Google Scholar
Hessels, R. S., Holleman, G. A., Kingstone, A., Hooge, I. T. C., Kemner, C. (2019). Gaze allocation in face-to-face communication is affected primarily by task structure and social context, not stimulus-driven factors. Cognition, 184, 28–43. https://doi.org/10.1016/j.cognition.2018.12.005 Google Scholar
Hietanen, J. K., Kylliäinen, A., Peltola, M. J. (2019). The effect of being watched on facial EMG and autonomic activity in response to another individual’s facial expressions. Scientific Reports, 9(1), 14759. https://doi.org/10.1038/s41598-019-51368-6 Google Scholar
Ho, S., Foulsham, T., Kingstone, A. (2015). Speaking and listening with the eyes: Gaze signaling during dyadic interactions. PLOS ONE, 10(8), Article e0136905. https://doi.org/10.1371/journal.pone.0136905 Google Scholar
Hutchins, T. L., Brien, A. (2016). Conversational topic moderates social attention in autism spectrum disorder: Talking about emotions is like driving in a snowstorm. Research in Autism Spectrum Disorders, 26, 99–110. https://doi.org/10.1016/j.rasd.2016.03.006 Google Scholar
Itti, L., Koch, C. (2001). Computational modelling of visual attention. Nature Reviews Neuroscience, 2, 194–203. Google Scholar | Crossref | Medline | ISI
Kendon, A. (1967). Some functions of gaze-direction in social interaction. Acta Psychologica, 26, 22–63. Google Scholar | Crossref | Medline | ISI
Kleinke, C. L. (1986). Gaze and eye contact: A research review. Psychological Bulletin, 100(1), 78–100. Google Scholar | Crossref | Medline | ISI
Koch, C., Ullman, S. (1985). Shifts in selective visual attention: Towards the underlying neural circuitry. Human Neurobiology, 4, 219–227. Google Scholar | Medline
Laidlaw, K., Foulsham, T., Kuhn, G., Kingstone, A. (2011). Potential social interactions are important to social attention. Proceedings of the National Academy of Sciences of the United States of America, 108(14), 5548–5553. Google Scholar | Crossref | Medline
Livingston, L. A., Happé, F. (2017). Conceptualising compensation in neurodevelopmental disorders: Reflections from autism spectrum disorder. Neuroscience and Biobehavioral Reviews, 80, 729–742. https://doi.org/10.1016/j.neubiorev.2017.06.005 Google Scholar
Lord, C., Risi, S., Lambrecht, L., Cook, E. H., Leventhal, B. L., Dilavore, P. C., . . .Rutter, M. (2000). The Autism Diagnostic Observation Schedule-Generic: A standard measure of social and communication deficits associated with the spectrum of Autism. Journal of Autism and Developmental Disorders, 30(3), 205–223. Google Scholar | Crossref | Medline | ISI





%20(3)-Photoroom.png)




Comentarios